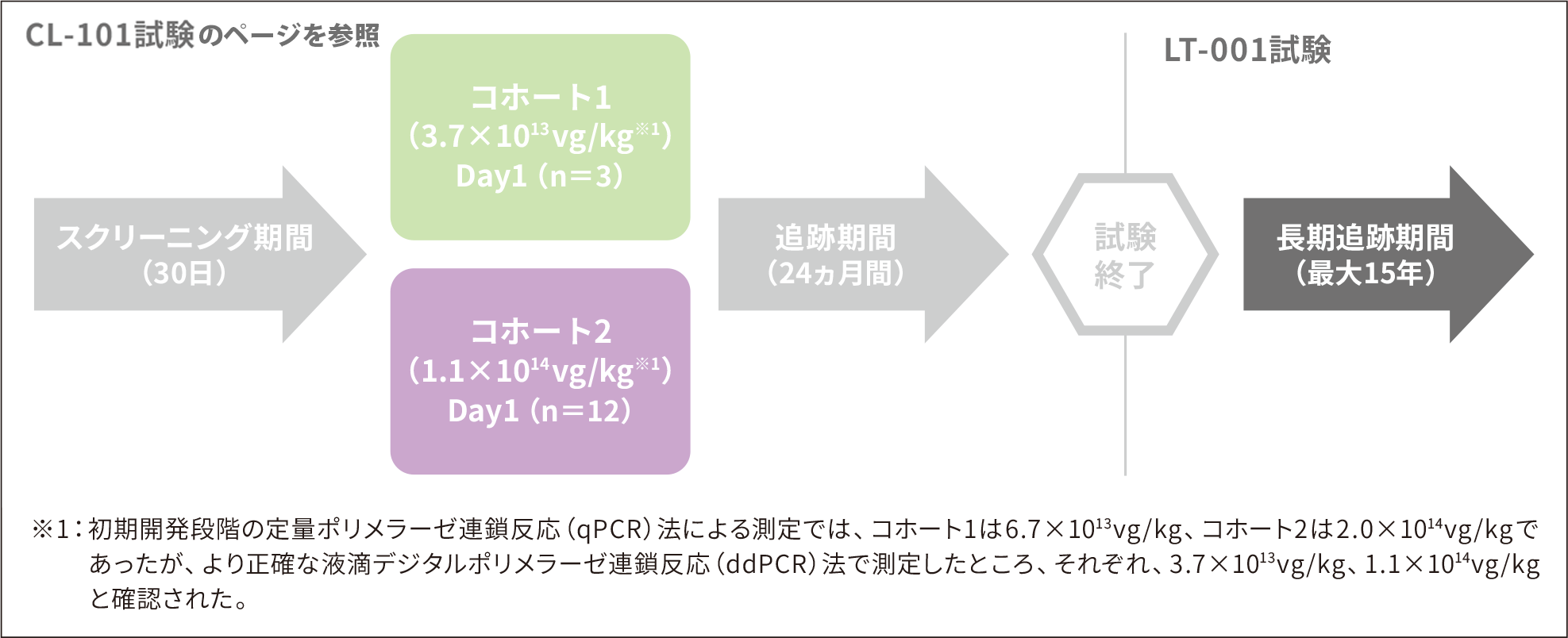
LT-001試験
ゾルゲンスマはCL-101試験、LT-001試験、CL-303試験、CL-304試験及びCL-102試験の成績に基づき承認された。参考として海外長期投与試験(LT-101試験)において、承認時までに得られている結果を示した(有効性:2019年5月31日カットオフ、安全性:2019年3月8日カットオフ)。
-

2. 有効性
(2019年5月31日カットオフ)
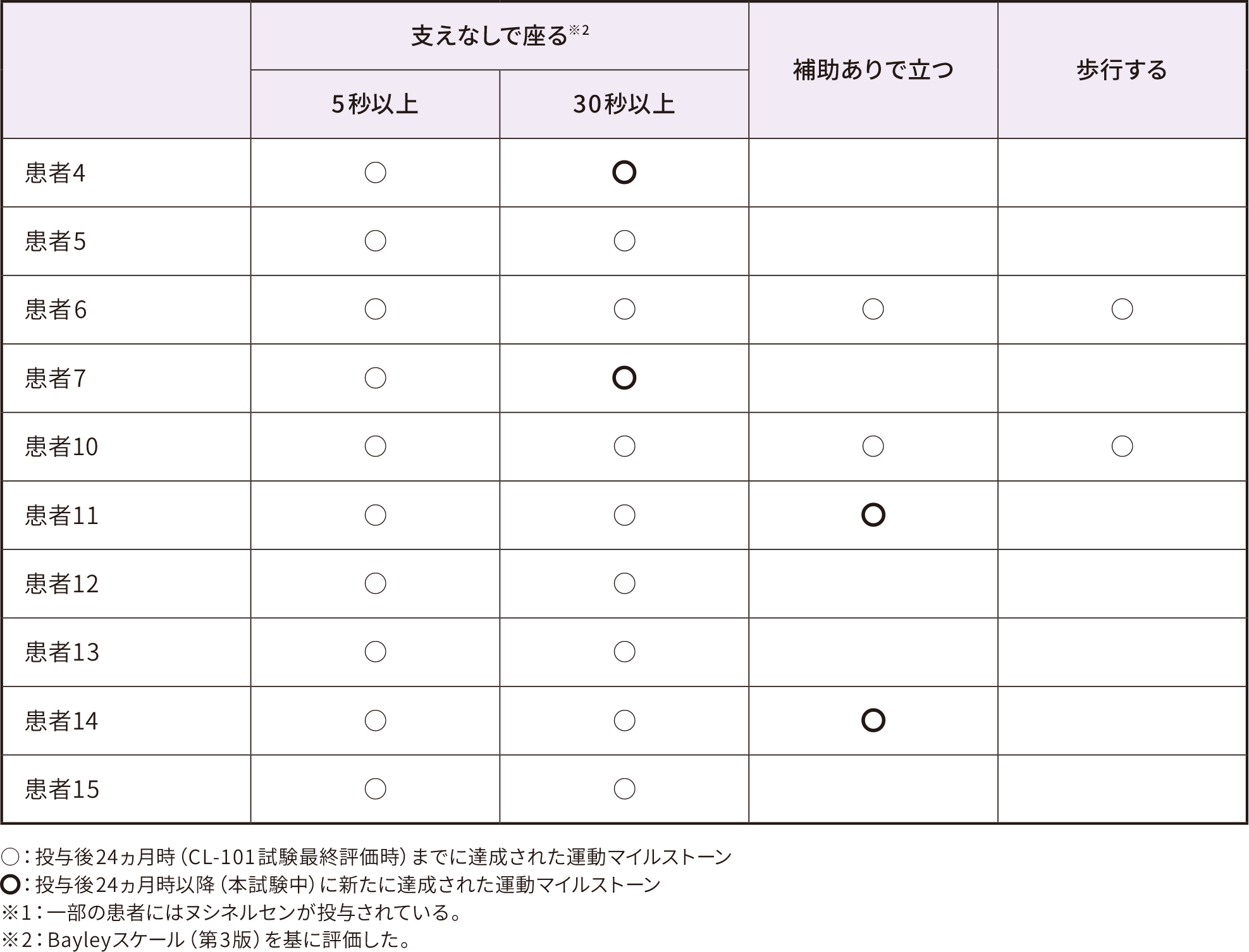
- データカットオフ時における運動マイルストーン評価
登録された13例全例(コホート1が3例、コホート2が10例)で、CL-101試験の期間中に得られた運動マイルストーンの達成が維持されており、新たに2例(患者11及び14)で「補助ありで立つ」ことが可能となった。
長期フォローアップ期間で新たに達成された運動マイルストーン(コホート2※1)
-

3. 安全性(2019年3月8日カットオフ)
-
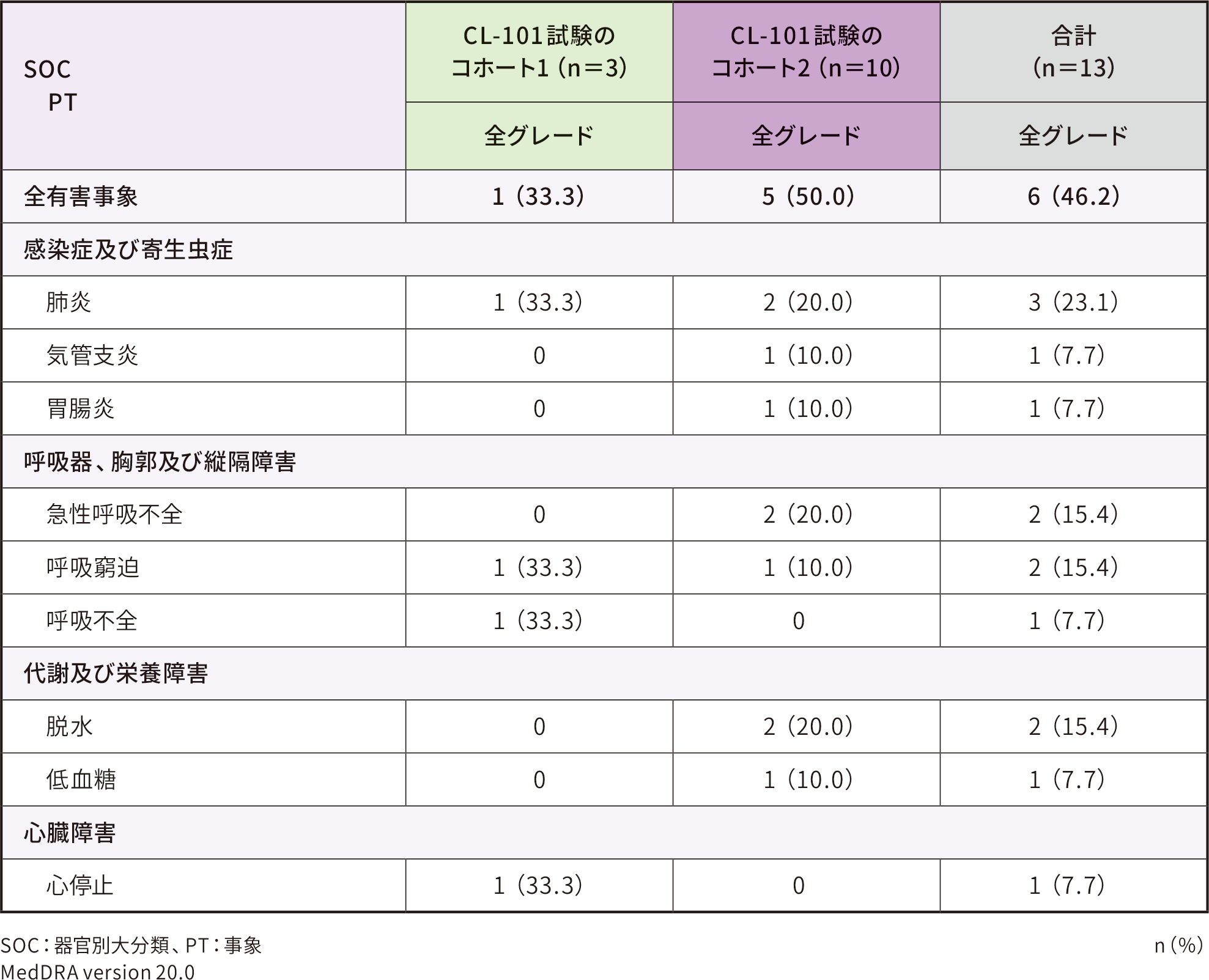
安全性解析対象集団
本試験では、重篤な有害事象及び特に注目すべき有害事象のみを収集した。データカットオフ時において、安全性解析対象集団13例※中(CL-101試験のコホート1:3例、コホート2:10例、以下同順)、有害事象は6例(46.2%)〔1例(33.3%)、5例(50.0%)〕に認められたが、いずれの有害事象もゾルゲンスマとの因果関係は否定された。収集された有害事象はいずれも重篤な有害事象であった。なお、データカットオフ時までに死亡例は認められなかった。
※:15例がCL-101試験を完了したが、うち2例が地理的な要因及び両親の判断のために本試験に登録されなかった。
重篤な有害事象
【用法及び用量又は使用方法】(一部抜粋)
通常、体重2.6kg以上の患者(2歳未満)には、1.1×1014ベクターゲノム(vg)/kgを60分かけて静脈内に単回投与する。