1)社内資料:Ⅰ型脊髄性筋萎縮症患者を対象とした海外第Ⅰ相試験(CL-101試験)(承認時評価資料)
2)Mendell JR. et al.: N Engl J Med. 2017; 377(18): 1713-1722
COI:本論文はAveXis社の資金により行われた。著者にAveXis社の社員が含まれる。
3)Al-Zaidy SA. et al.: J Neuromuscul Dis. 2019; 6(3): 307-317
COI:本論文はAveXis社の資金により行われた。著者にAveXis社よりコンサルティング料を受領した者及び社員が含まれる。

※ 1 :最初に登録された9例は初期の治験実施計画書に基づき登録された。初期の治験実施計画書は9ヵ月齢以下の患者の登録を容認するものであったが、その後6ヵ月齢以下に改訂された。
※ 2 :登録された全ての患者は、SMN1遺伝子の両アレル欠失であった。
※ 3 :c.859G>Cを有する患者については、有しない患者に比べて臨床所見が軽度かつ少数例であることを考慮し、可能な限り均質な対象患者を本試験に登録し、本品の有効性及び安全性を評価するために除外された。
※ 4 :用いられた治験製品はNationwide Children’s Hospital(NCH)が製造し、患者全員が同一ロットの製品を用いた。
※ 5 :最初の患者には初期の治験実施計画書に基づき30分かけて投与された。
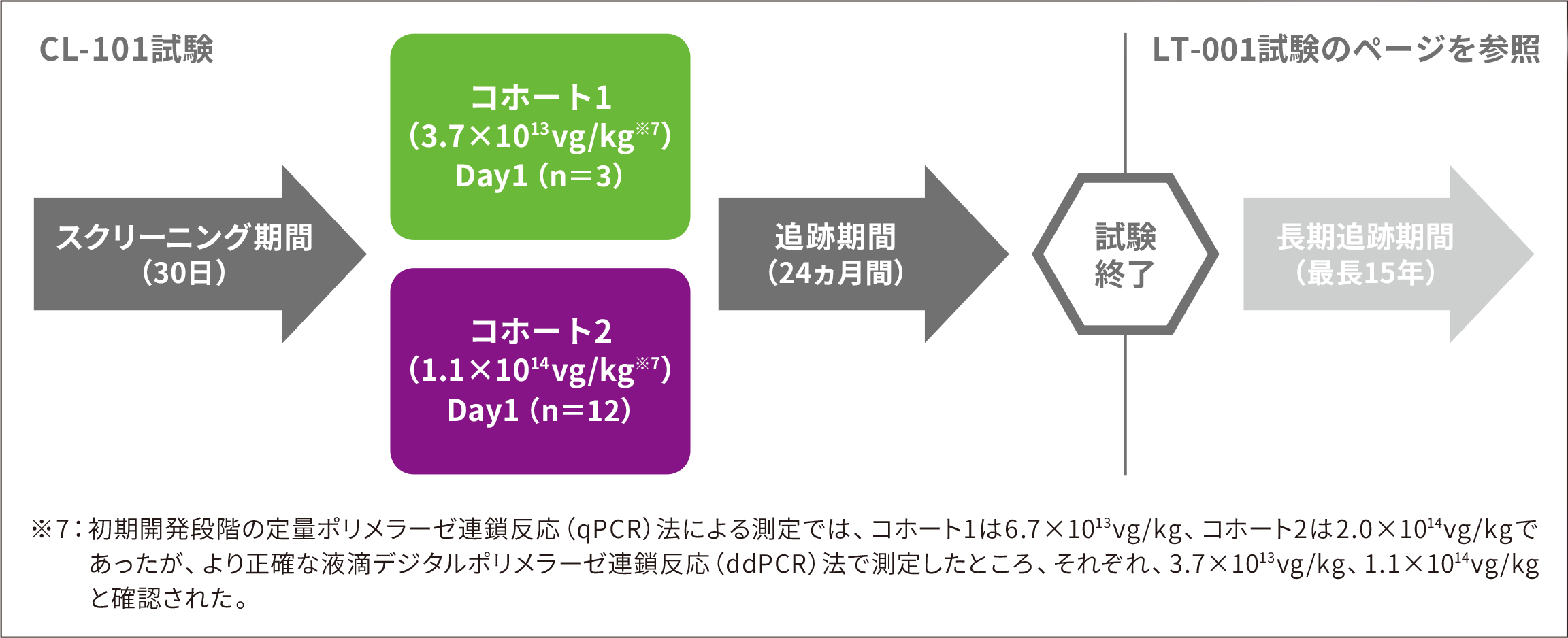
※ 6 :治験実施計画書では、コホート1(6.7×1013vg/kg)、コホート2A、コホート2B(2.0×1014vg/kg)、コホート3(3.3×1014vg/kg)の4コホートで実施する計画であったが、コホート2で顕著な有効性が認められ、また肝機能検査値上昇リスクの可能性が示されたことから、コホート3の登録が中止された。なお、コホート2A及びコホート2Bは単一のコホート2として提示する。なお、上述の用量は初期開発段階での測定値である(詳細は※7参照)。
※ 7 :初期開発段階の定量ポリメラーゼ連鎖反応(qPCR)法による測定では、コホート1は6.7×1013vg/kg、コホート2は2.0×1014vg/kgであったが、より正確な液滴デジタルポリメラーゼ連鎖反応(ddPCR)法で測定したところ、それぞれ、3.7×1013vg/kg、1.1×1014vg/kgと確認された。
※ 8 :治験実施計画書の改訂前に登録された最初の患者にはプレドニゾロンの予防投与は行われていない。
※9:臨床的に意味のある有効性評価項目と考えられたため、本評価項目はデータ解析前に追加された。
※10:嚥下機能検査で低濃度液体を摂取可能であることが確認され、栄養チューブによる機械的な栄養補助を受けない状態で、WHO基準で患者の年齢及び性別における第三四分位数を超える体重が維持されている患者、と定義した。
| 永続的な呼吸補助を 必要としない生存 |
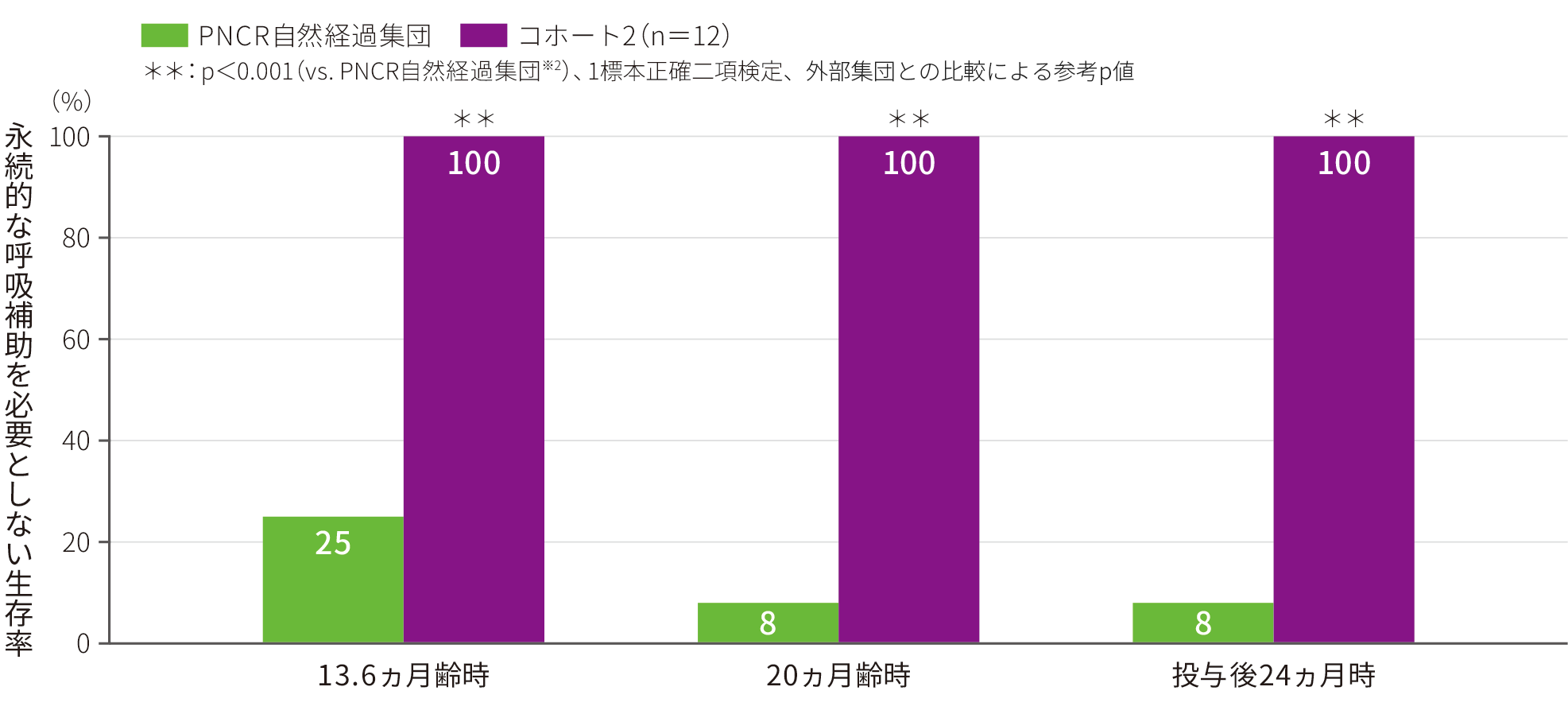
出生日から「死亡」又は「永続的な呼吸補助」までの期間とした。未治療のⅠ型SMA患者の同生存期間の中央値は10.5ヵ月である4)。標準治療では、この定義に基づく患者の推定生存率は 13.6ヵ月齢で25%であり、20ヵ月齢で8%である4)。 |
|---|---|
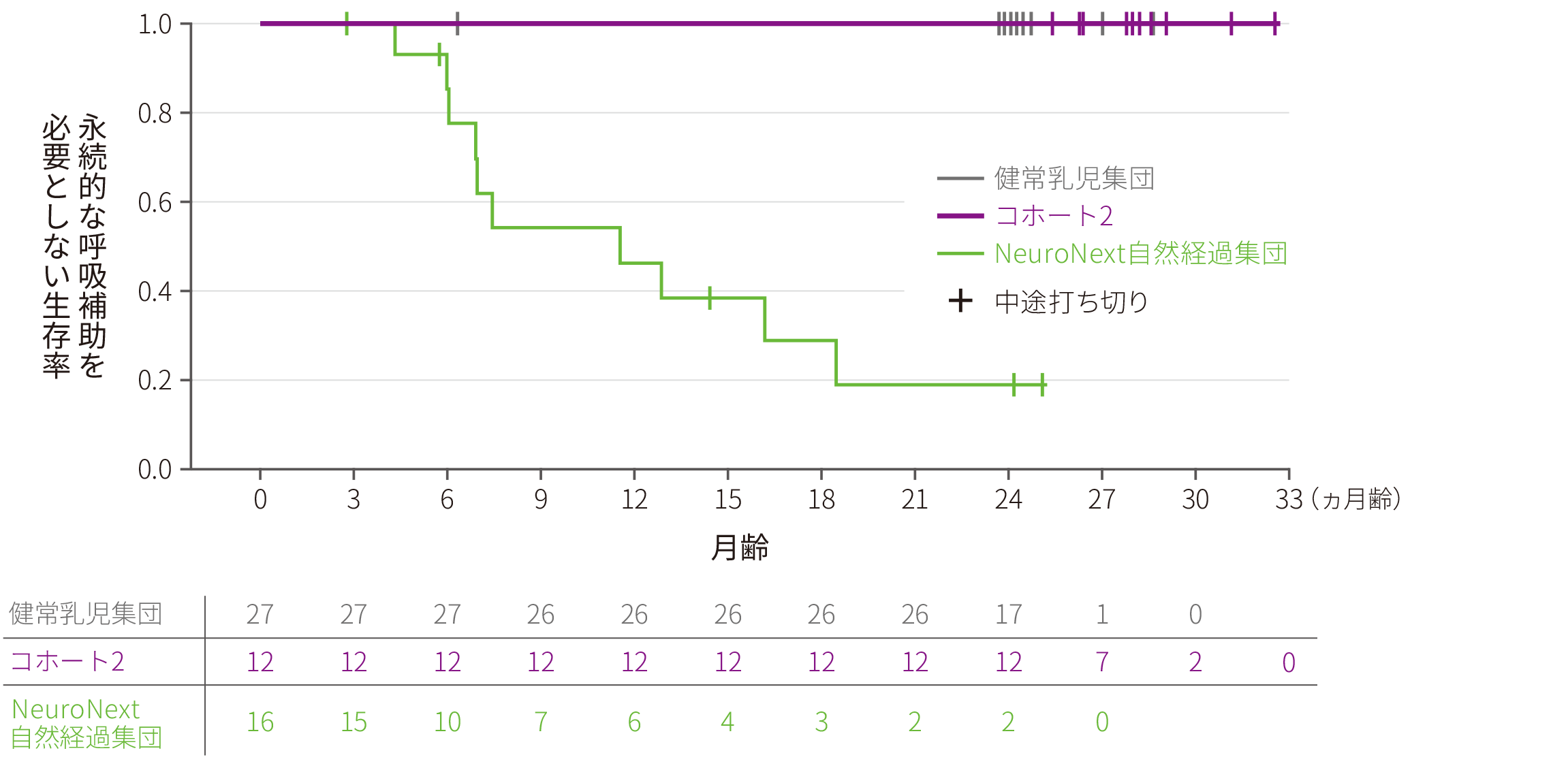
| CHOP-INTEND スコア |
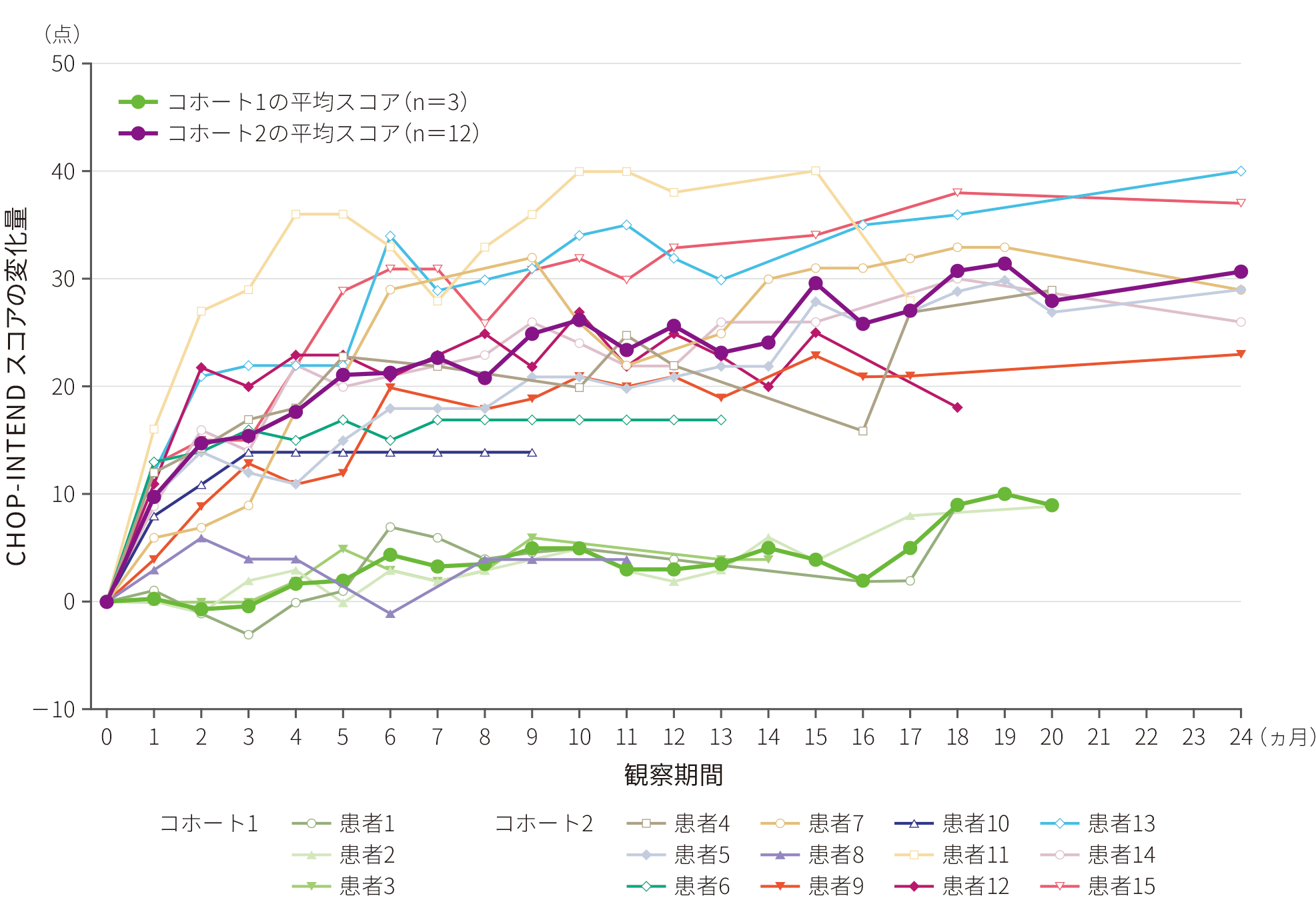
Ⅰ型SMA患者における運動機能の状態及び障害度を特異的に評価するために開発、バリデートされたスケールである(0から64点)。4点以上の上昇が臨床的に意義のある改善とされる。自然経過研究から、Ⅰ型SMA患者は40点以上への到達が困難であると考えられた5)。他の研究でも、Ⅰ型SMA患者( SMN2遺伝子コピー数が2)では、健常乳児よりも有意に低く(3ヵ月齢時:20.2 vs 50.1)、また6ヵ月齢時から12ヵ月齢時までに平均10.71点減少したことが示されている6)。 |
| 運動マイルストーン | 医療スタッフ、家族等により院内、自宅等で撮影された映像を、治験実施医療機関の理学療法士、治験責任医師及び治験分担医師の助言を基に外部委託業者が編集し、独立した外部の評価者(1名)が中央判定として評価する。なお、治験実施医療機関での評価と独立した外部の評価者の評価が異なった場合は、両者間で協議した後に、独立した外部の評価者が評価を決定する。幼児のSMA患者での標準治療では「寝返りをする」や「支えなしで座る」などの主要な運動マイルストーンの達成が不可能であることが、自然経過研究で報告されている7)。 |
| 永続的な呼吸補助を 必要としない生存 |
永続的な呼吸補助は、14日以上連続して16時間/日以上の呼吸補助(非侵襲的な呼吸補助を含み、可逆的な急性疾患及び周術期の呼吸補助を除く)を必要とする状態、と定義した。 |
|---|---|
| 成長能力が維持された患者の割合 | 嚥下機能検査で低濃度液体を摂取可能であることが確認され、栄養チューブによる機械的な栄養補助を受けない状態で、WHO基準で患者の年齢及び性別における第三四分位数を超える体重が維持されている患者、と定義した。 |
| 安全性 | |
|---|---|
| 安全性解析対象集団 | ゾルゲンスマ投与を受けた全ての患者 |
| 有効性 | |
| ITT解析対象集団 | ゾルゲンスマ投与を受けた全ての患者 |
| 最大の解析対象集団(FAS) | ゾルゲンスマ投与を受けた後、1回以上の評価データがある全ての患者 |
| 参考:外部のSMA自然経過集団※11 | |
| PNCR自然経過集団4) | 主要な有効性評価の対照集団として利用。SMA治療に高度な専門知識を持つ3つの大規模医療センター(米国)で追跡されたSMA患者データベース337例から抽出された23例で構成 |
| NeuroNext自然経過集団8, 9) | 探索的分析において補助的に用いられる対照集団。NeuroNext自然経過試験は、臨床試験を模倣するように設計された、縦断的、多施設、前向き自然経過試験である。6ヵ月齢未満のSMA患者26例(及び対照健常乳児27例)で構成 |
ITT:Intent-to-Treat、FAS:Full Analysis Set、PNCR:Pediatric Neuromuscular Clinical Research、
NeuroNext:The Network for Excellence in Neuroscience Clinical Trials
※11:参考として外部のSMA自然経過集団を対照とすることについては、倫理的及び科学的考察に基づいて規制当局と協議し、合意に至っている。
| 永続的な呼吸補助を 必要としない生存 | 1標本正確二項検定を用いて、13.6ヵ月齢時及び20ヵ月齢時におけるPNCR自然経過推定生存率4)である25%(13.6ヵ月齢時)及び8%(20ヵ月齢時及び投与後24ヵ月時)と比較した。 |
|---|---|
| CHOP-INTEND スコア | 混合効果モデル反復測定法(MMRM)を用いて解析した。モデルにはベースライン値からの変化量に対し、コホート、来院、ベースライン、コホート×来院及びベースライン値×来院の交互作用を含め、FASを対象とした。分散共分散構造はunstructuredとし、収束しない場合にはvariance componentsを用いた。 |
| 運動マイルストーン | FASを用いてコホート別に要約した。これらは、片側正確二項検定を用いて、Ⅰ型SMAにおける未治療患者での推定達成率(0%)と比較した。 |
FAS:Full Analysis Set、NAV:Not Available
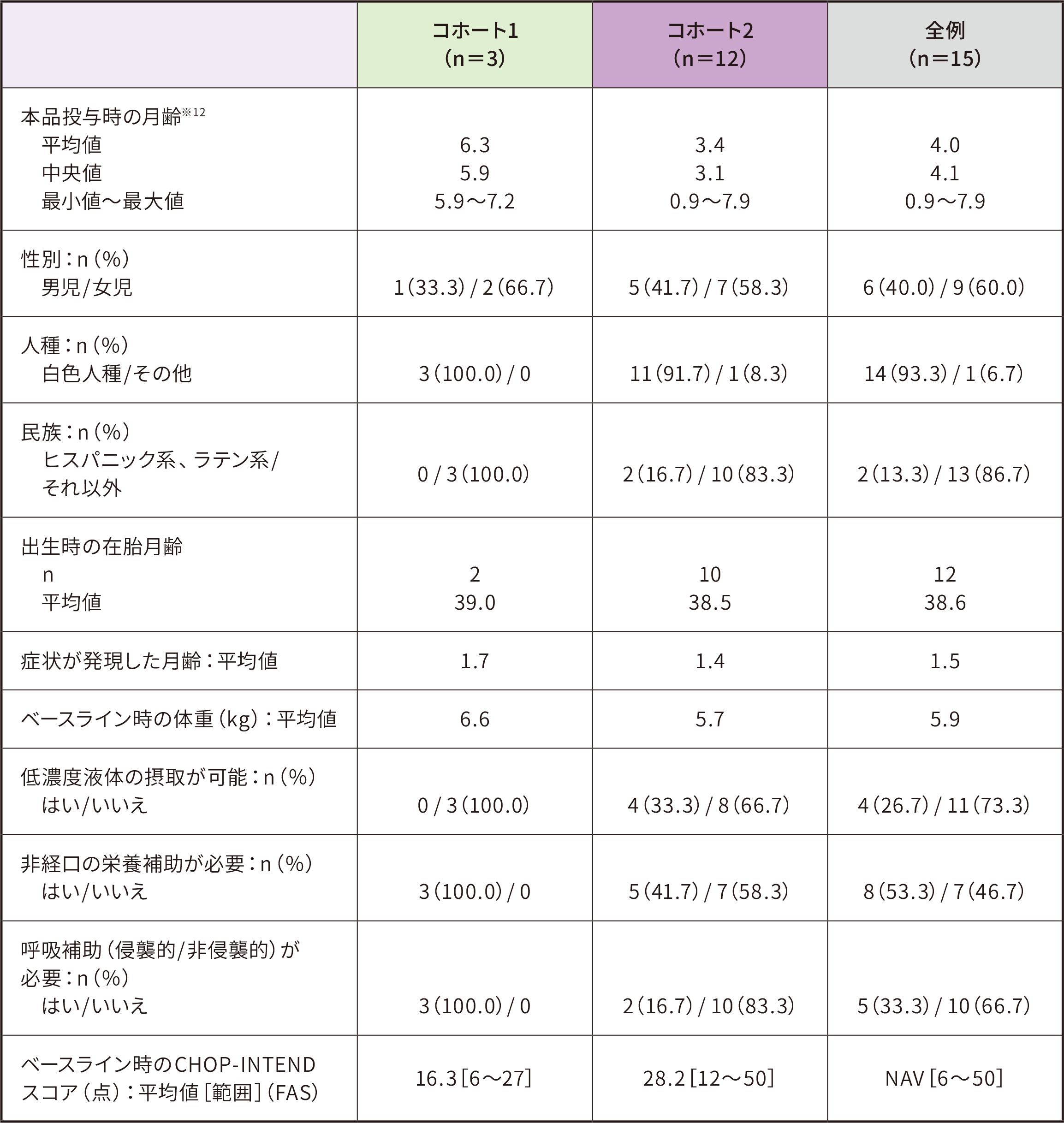
※12:試験開始時は9ヵ月齢以下の患者を対象としていたが、試験途中で治験実施計画書を改訂し、6ヵ月齢以下の患者を対象とすることとした。 そのため、一部の患者では投与時の年齢が6ヵ月齢を超えていた。

※ 1 :PNCR自然経過での生存率は25%(13.6ヵ月齢時)、又は8%(20ヵ月齢時)である。なお、20ヵ月超のPNCRデータは利用できないため、投与後24ヵ月時は、PNCR自然経過における20ヵ月齢時の生存率と比較した。
※ 2 :本試験は第Ⅰ相試験であり対照群を設定していないため、外部集団である自然経過集団との検定結果を参考値として記載した。
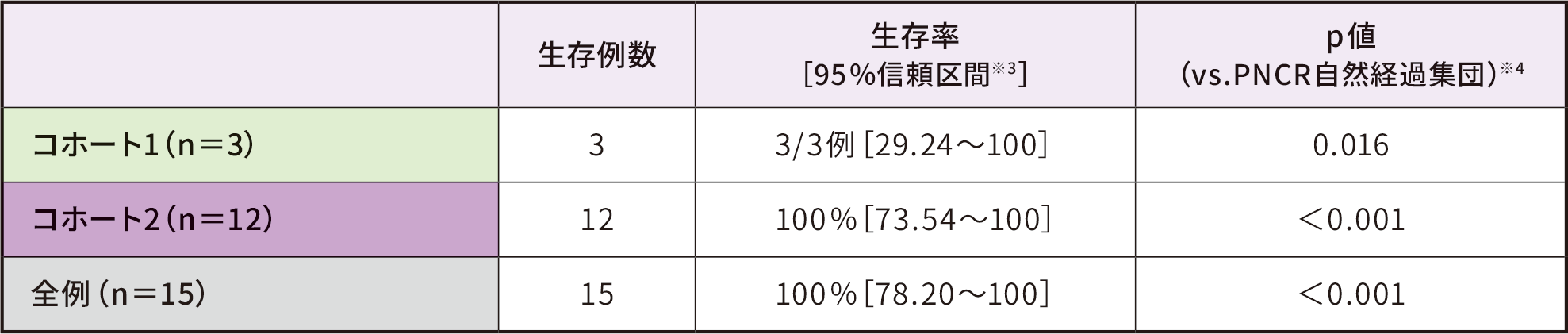
※ 3 :1標本正確二項検定からの信頼区間。
※ 4 :本試験は第Ⅰ相試験であり対照群を設定していないため、外部集団である自然経過集団との検定結果を参考値として記載した。検定では、1標本正確二項検定を用いて、「SMN2遺伝子コピー数が2の患者」の自然経過での13.6ヵ月齢時の推定生存率25%と比較した。
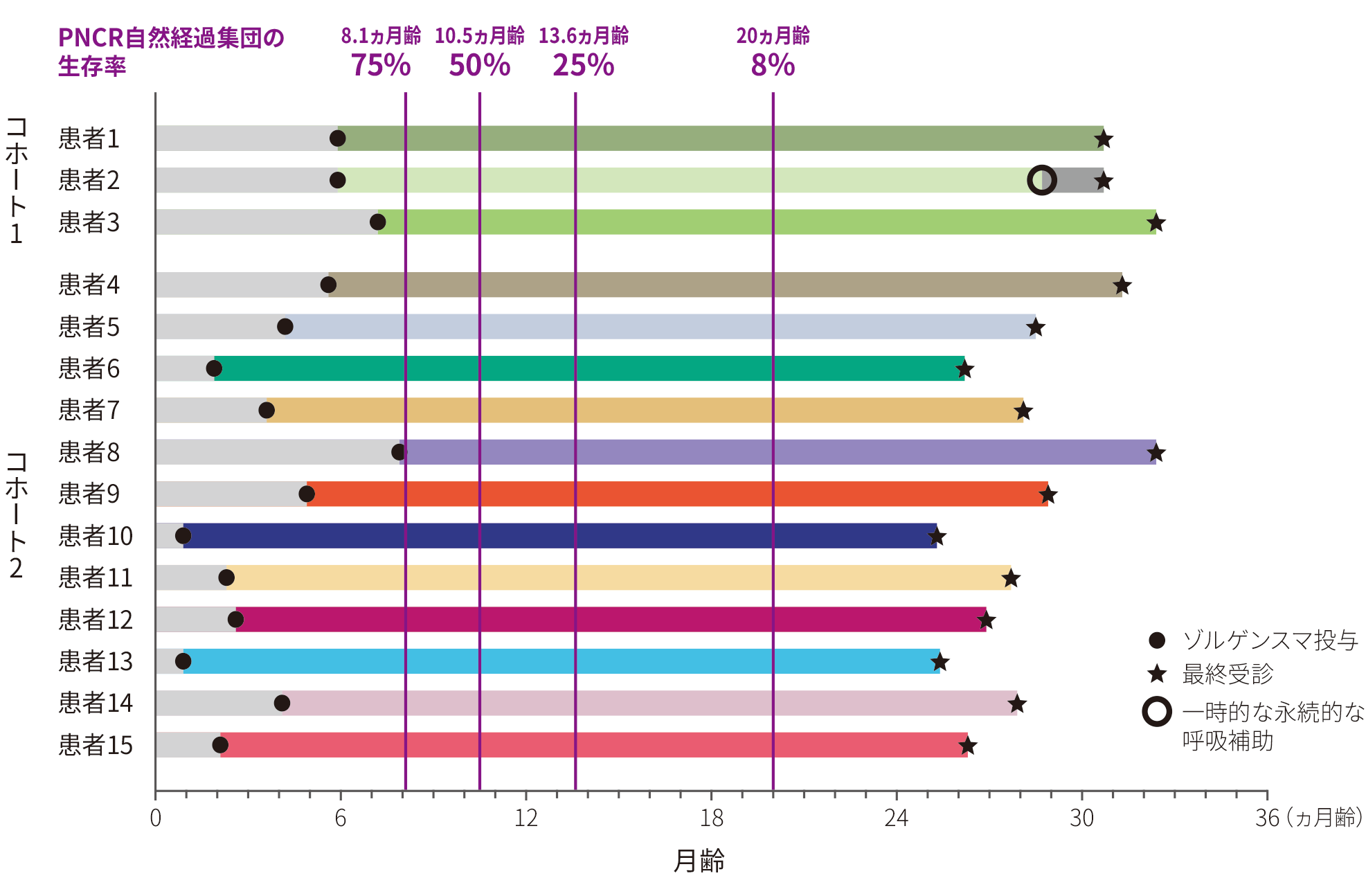
※ 5 :コホート1の1例が、本品投与後22ヵ月を経過した時点で流涎過多のために永続的な呼吸補助の基準に一時的に抵触したものの、本品投与後24ヵ月時点の評価における呼吸補助は16時間未満日であったことから、永続的な呼吸補助の基準には抵触しないと判定された。
※ 6 :CHOP-INTENDスコアは、4点以上の上昇が臨床的に意義のある改善とされる。
※ 7 :24ヵ月の観察期間を終え、試験終了時点までにCL-101試験として収集されたデータ(規定外来院を含む)のうち、全てのスコアが評価された 最終時点の合計を記載している。
※ 8 :Ⅰ型SMA患者は、CHOP-INTENDスコア40点以上への到達が困難であることが自然経過研究で示されている。
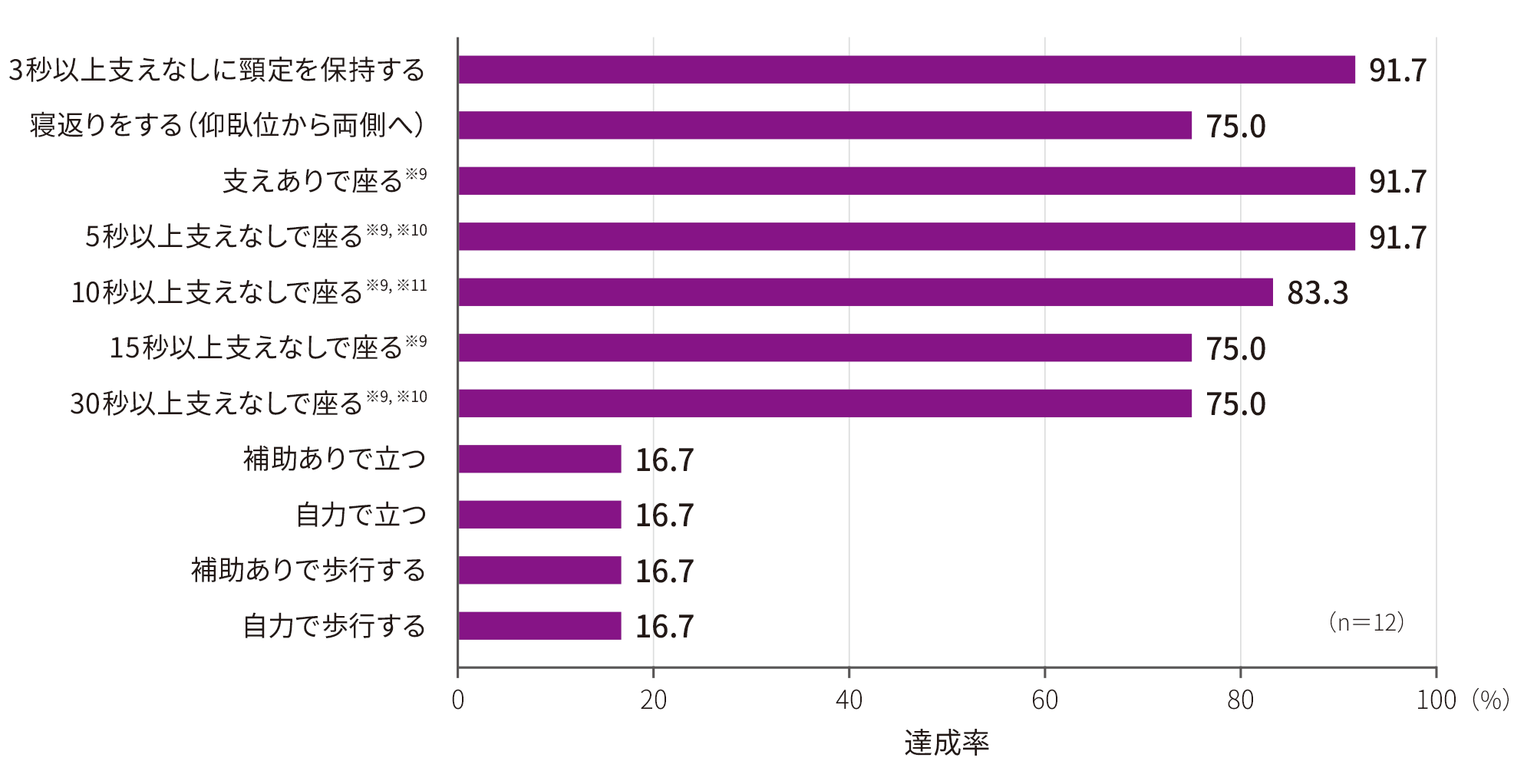
※ 9 :「5秒以上、10秒以上、15秒以上又は30秒以上の支えなしで座る」を達成した患者は、「支えありで座る」の項目にも該当する。また、「30秒以上支えなしで座る」ことができる患者は、「15秒以上」、「10秒以上」及び「5秒以上支えなしで座る」の項目にも該当する〔世界保健機関(WHO)定義〕。
※10:Bayleyスケール(第3版)を基に評価した。
※11:WHO運動マイルストーンの動作基準を基に評価した。

※12:臨床的に意味のある有効性評価項目と考えられたため、本評価項目はデータ解析前に追加された。
※13:嚥下機能検査で低濃度液体を摂取可能であることが確認され、栄養チューブによる機械的な栄養補助を受けない状態で、WHO基準で患者 の年齢及び性別における第三四分位数を超える体重が維持されている患者、と定義した。

※:16例がスクリーニングを受けたが、抗AAV9抗体が陽性であった1例が登録されなかった。
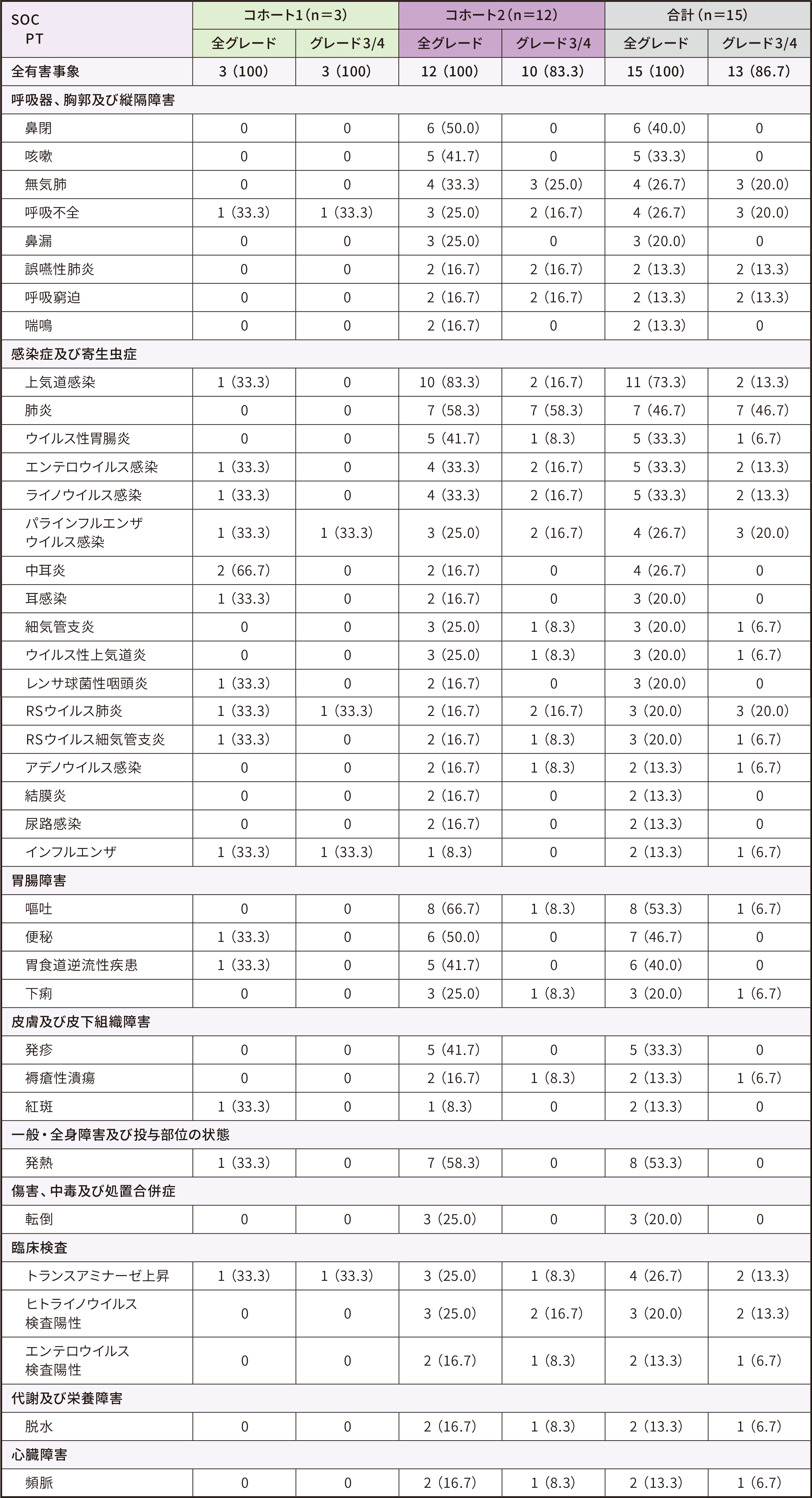
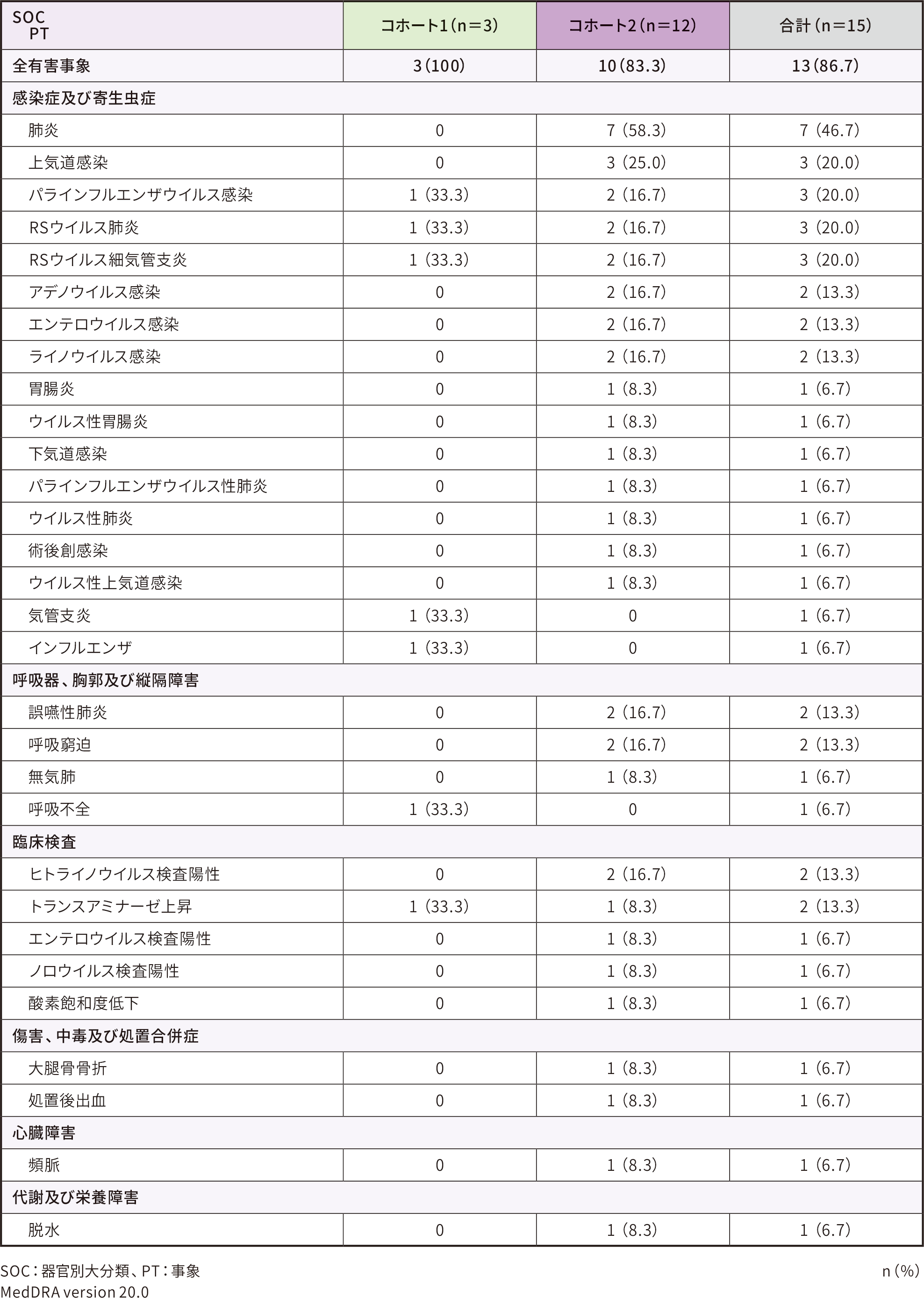

※ 1 :NeuroNextネットワークに登録された6ヵ月齢以下の妊娠36~42週に生まれたSMA患者26例のうち、SMN2遺伝子コピー数2の患者16例のみで構成されたコホートである。
※ 2 :NeuroNextネットワークに登録された6ヵ月齢以下の妊娠36~42週に生まれた健常乳児27例で構成されたコホートである。
ゾルゲンスマ投与群(CL-101試験のコホート2、以下コホート2)、NeuroNext自然経過集団、及び健常乳児集団の生存分析にはカプラン・マイヤー法を用いた。
| 永続的な呼吸補助を 必要としない生存 |
永続的な呼吸補助は、14日以上連続して16時間/日以上の呼吸補助(非侵襲的な呼吸補助を含み、可逆的な急性疾患及び周術期の呼吸補助を除く)を必要とする状態、と定義した。 |
|---|
コホート2とNeuroNext自然経過集団を比較した。NeuroNext自然経過集団では、3ヵ月齢ごとに評価した。NeuroNext自然経過集団との比較のために、コホート2では、毎月の来院時※3の月齢を「0ヵ月齢(~1.5月齢)」、「3ヵ月齢(1.5~4.5ヵ月齢)」、「6ヵ月齢(4.5~7.5ヵ月齢)」に分類した。
※ 3 :投与後7、14、21、30日時、以降投与後1年までは1ヵ月ごと、投与後2年までは3ヵ月ごとに来院した。
※ 4 :本事後解析では、NeuroNext研究におけるⅠ型SMA自然経過集団及び健常乳児集団と比較評価しており、治験時に評価対象となったCL101試験で比較対象としたPediatric Neuromuscular Clinical Research(PNCR)における未治療のI型SMA患者の自然経過での結果〔20ヵ月齢時の生存率(8%)等〕とは異なる。
文献
1)社内資料:Ⅰ型脊髄性筋萎縮症患者を対象とした海外第Ⅰ相試験(CL-101試験)(承認時評価資料)
2)Mendell JR. et al.: N Engl J Med. 2017; 377(18): 1713-1722
3)Al-Zaidy SA. et al.: J Neuromuscul Dis. 2019; 6(3): 307-317
4)Finkel RS. et al.: Neurology. 2014; 83(9): 810-817
5)Kolb SJ. et al.: Neurol Clin. 2015; 33(4): 831-846
6)Glanzman AM. et al.: Neuromuscul Disord. 2010; 20(3); 155-161
7)Lin CW. et al.: Pediatr Neurol. 2015; 53(4); 293-300
8)Kolb SJ. et al.: Ann Clin Transl Neurol. 2016; 3(2): 132-145
9)Kolb SJ. et al.: Ann Neurol. 2017; 82(6): 883-891